Un conocimiento profundo y un cumplimiento estricto de la Requisitos de la FDA para los sueros blanqueadores se ha convertido en una necesidad absoluta para la supervivencia de las marcas de cuidado de la piel que se dirigen al mercado estadounidense. La Administración de Alimentos y Medicamentos de EE.UU. (FDA) ha endurecido continuamente la normativa, pasando de las restricciones a la prohibición. hidroquinona en productos de venta libre. Cualquier error de apreciación puede dar lugar a la incautación del producto, cartas de advertencia o acciones legales. Este artículo ofrece un análisis en profundidad del marco de Requisitos de la FDA para los sueros blanqueadores en 2026, ofreciendo a las marcas una hoja de ruta clara para el cumplimiento.
I. Fundamento normativo: La posición fundamental de la FDA que debe entenderse en primer lugar

Antes de entrar en detalles, las marcas deben tener clara la premisa fundamental: los requisitos de la FDA para los sueros blanqueadores se basan en el principio de “la seguridad ante todo”. Actualmente, ningún suero blanqueador de venta libre está aprobado por la FDA.
1.Core Prohibición: La ilegalidad de la hidroquinona en productos de venta libre
Este es el aspecto más crítico de los requisitos de la FDA para los sueros blanqueadores. Según la Ley CARES En vigor desde 2020, todos los productos OTC para aclarar la piel que contienen hidroquinona han sido reclasificados como “nuevos medicamentos”. Esto significa que la comercialización de tales productos es ilegal a menos que una marca complete el largo y costoso proceso de Solicitud de Nuevo Medicamento (NDA) y obtenga la aprobación. La FDA ha enviado cartas de advertencia a varias empresas que no cumplen la normativa.
2.Línea Roja Absoluta: Prohibición estricta del mercurio y otros metales pesados
Los requisitos de la FDA para los sueros blanqueadores prohíben explícitamente añadir cualquier forma de mercurio (por ejemplo, cloruro mercurioso, calomelano). El mercurio es muy tóxico para el sistema nervioso humano, los riñones y otros órganos. Los consumidores deben estar atentos a alias como “cloruro mercurioso” o “calomel” en las listas de ingredientes.
3.La única excepción: La vía de los medicamentos sujetos a receta médica
En la actualidad, el único producto con hidroquinona aprobado por la FDA en EE.UU. es el medicamento de venta con receta Tri-Luma, aprobado únicamente para el tratamiento a corto plazo de manchas oscuras moderadas a graves relacionadas con el melasma.
II. Análisis en profundidad: La lógica de la seguridad tras los estrictos requisitos de la FDA
El carácter estricto de los requisitos de la FDA para los sueros blanqueadores se deriva de la evaluación de los riesgos demostrados y del mandato de proteger la salud de los consumidores.
1.Peligros confirmados para la salud derivados de los productos no conformes
Los informes de efectos adversos recogidos por la FDA indican que el uso de productos de venta libre que contienen hidroquinona puede provocar:
- Ocronosis exógena: Pigmentación potencialmente permanente de la piel de color negro azulado.
- Irritación cutánea grave, erupciones cutáneas y dermatitis de contacto.
- Sensibilidad cutánea anormalmente aumentada.
2. Preocupaciones de larga data sobre la carcinogenicidad
Ya en 2006, la FDA expresó su preocupación por el posible riesgo carcinogénico de la hidroquinona basándose en datos de estudios con animales. Aunque las pruebas en humanos siguen sin ser concluyentes, esta preocupación constituye el contexto histórico de su prudente regulación.
3.Control del uso indebido no supervisado
Los consumidores que carecen de orientación profesional pueden utilizar los productos en exceso durante periodos prolongados, lo que amplifica los riesgos. Los requisitos de la FDA para los sueros blanqueadores pretenden confinar estos potentes ingredientes estrictamente a entornos con supervisión médica.
III. Guía de acción para las marcas: Desarrollo de sueros blanqueadores conformes al marco de la FDA
Ante los claros requisitos de la FDA para los sueros blanqueadores, las marcas deben ajustar la I+D, las declaraciones y las estrategias de entrada en el mercado.
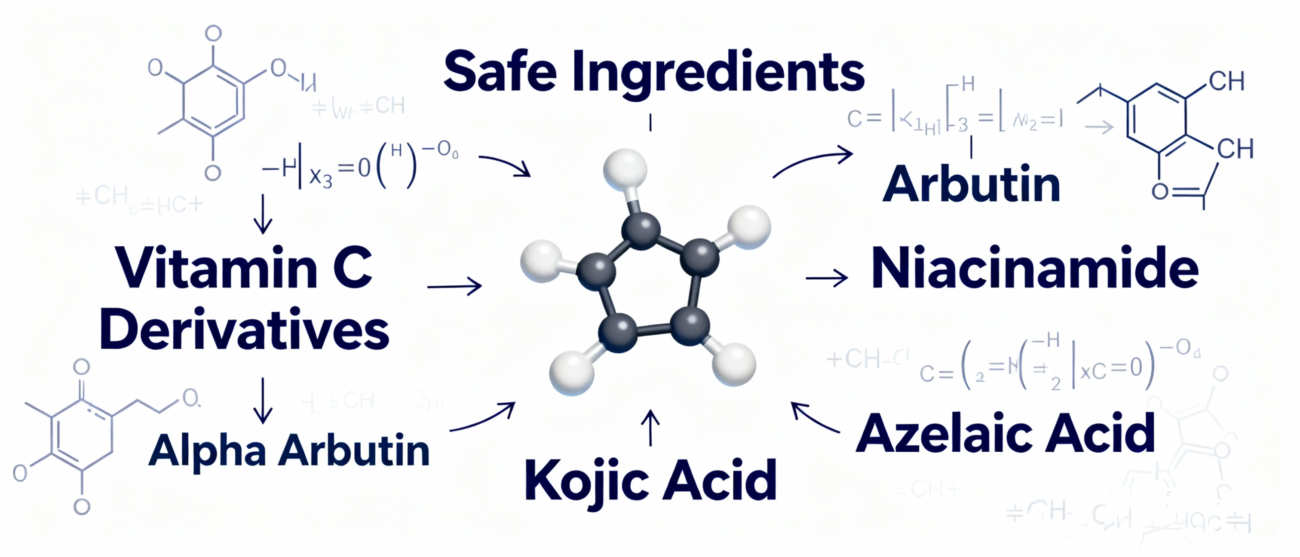
1.Estrategia de formulación: Cambio a sistemas de ingredientes alternativos seguros y eficaces
Abandonar por completo la hidroquinona en los productos de venta libre. Hay que centrarse en ingredientes con un historial de seguridad bien establecido y mecanismos de acción claros:
- Antioxidación e inhibición de la producción de melanina: Utilice derivados estables de la vitamina C, ácido kójico, arbutina, etc.
- Bloqueo de la transferencia de melanina: Niacinamida es una opción básica, segura y validada por la investigación.
- Acelerar la renovación de los queratinocitos: Utilice alfahidroxiácidos o ácido salicílico (tenga en cuenta los límites de concentración) adecuadamente para ayudar a desvanecer el pigmento superficial.
2.Estrategia de reclamación: Redacción precisa, estricta observancia de los límites “cosméticos
Las declaraciones de los productos deben ajustarse estrictamente a la definición de cosmético. Cualquier declaración que implique que el producto puede “tratar” o “curar” una enfermedad de la piel hará que se clasifique como medicamento.
- Ejemplos de solicitudes conformes: “Ayuda a iluminar el tono de la piel”, “mejora el aspecto apagado”, “ayuda a reducir la aparición de manchas oscuras inducidas por el sol”.”
- Reclamaciones de alto riesgo que hay que evitar: “Trata el melasma”, “elimina las pecas”, “bloquea el melanoma”, “proporciona efectos blanqueadores de grado clínico”.”
3.Cumplimiento de la normativa: Los dos únicos caminos
Según los requisitos de la FDA para los sueros blanqueadores, las marcas sólo tienen dos caminos:
- La vía principal: Desarrollar cosméticos OTC conformes
- El camino del nicho: Solicitar un nuevo medicamento
IV. Adaptación del mercado y comunicación al consumidor: Convertir el cumplimiento en un activo de confianza
En el nuevo entorno normativo, las marcas líderes deben interiorizar de forma proactiva los requisitos de la FDA para los sueros blanqueadores como una responsabilidad de marca.
1.Educación proactiva para construir una imagen transparente
Explique a los consumidores por qué se eligen alternativas más seguras, edúquelos sobre los riesgos de la hidroquinona y el mercurio, y transforme el cumplimiento de las normas en una reputación de profesionalidad y responsabilidad.
2.Orientar a los consumidores para identificar los productos no conformes
Ayude a los consumidores a desarrollar habilidades de discriminación para que desconfíen de los productos con un etiquetado incompleto, afirmaciones demasiado agresivas o de procedencia desconocida.
3.Abogar por una filosofía de cuidado de la piel saludable
Cambiar el enfoque del mercado de “blanqueamiento de la piel” a “uniformidad del tono de la piel, salud de la piel y luminosidad general”, en consonancia con la misión de la FDA de proteger la salud pública.
V. PREGUNTAS FRECUENTES: Profundización en la comprensión de los requisitos de la FDA
¿Existen actualmente sueros blanqueadores de venta libre aprobados por la FDA?
No, actualmente no hay ninguno. Los requisitos de la FDA para los sueros blanqueadores establecen claramente que todos los productos comercializados como sueros blanqueadores de venta libre que contienen hidroquinona se venden ilegalmente.
¿Cumple un suero blanqueador sin hidroquinona ni mercurio todos los requisitos de la FDA?
Evitar estos dos ingredientes prohibidos es la base del cumplimiento, pero no lo es todo. Las marcas también deben garantizar que todos los ingredientes son seguros en las concentraciones declaradas y que todas las declaraciones se ajustan estrictamente a la categoría cosmética.
¿Cómo debe responder una marca si recibe una carta de advertencia de la FDA sobre un producto blanqueador?
Normalmente, la FDA exige a la empresa que responda en un plazo de 15 días laborables con un plan de cese inmediato de las ventas, retirada del mercado y medidas correctoras.
¿Cómo podrían evolucionar en el futuro los requisitos de la FDA para los sueros blanqueadores?
Se espera que la FDA siga reforzando la represión de los productos OTC ilegales, especialmente los que se venden en línea o se importan, con mayores exigencias de seguridad y justificación científica.
VI. Conclusión y perspectivas: Encontrar oportunidades de innovación dentro del cumplimiento de la normativa
En 2026, el Requisitos de la FDA para los sueros blanqueadores trazar límites claros para la industria: la seguridad es la línea roja absoluta, y el cumplimiento es el único punto de entrada.
- Mantener la línea de base del cumplimiento: Abandonar por completo cualquier uso de hidroquinona o mercurio en productos de venta libre.
- Centrarse en la innovación científica: Aumentar la inversión en investigación sobre activos blanqueadores seguros, aumentando la competitividad mediante pruebas científicas sólidas.
- Construir un patrimonio fiduciario: Hacer de la transparencia, la educación del consumidor y las afirmaciones responsables elementos centrales de la comunicación de marca.
Las futuras marcas blanqueadoras de éxito en el mercado estadounidense serán aquellas que no sólo comprendan los requisitos de la FDA para los sueros blanqueadores, sino que los utilicen como piedra angular para crear un valor genuino en el marco de la seguridad, la ciencia y la integridad.
Si busca un fabricante OEM de confianza para el cuidado de la piel que potencie la conformidad y el éxito de sus productos, le invitamos a Contacto.