Ein gründliches Verständnis und die strikte Einhaltung der FDA-Anforderungen für Aufhellungsseren ist für Hautpflegemarken, die auf den US-amerikanischen Markt abzielen, zu einer absoluten Überlebensnotwendigkeit geworden. Die US-Lebensmittel- und Arzneimittelbehörde (FDA) hat die Vorschriften kontinuierlich verschärft und ist dabei von Einschränkungen zu einem Verbot von Hydrochinon in freiverkäuflichen Produkten (OTC). Jede Fehleinschätzung kann zur Beschlagnahme von Produkten, zu Warnschreiben oder zu rechtlichen Schritten führen. Dieser Artikel enthält eine eingehende Analyse des Rahmens für FDA-Anforderungen für Aufhellungsseren im Jahr 2026 und bietet den Marken einen klaren Fahrplan für die Einhaltung der Vorschriften.
I. Regulatorische Grundlage: Die Kernposition der FDA, die zuerst verstanden werden muss

Bevor wir uns mit den Einzelheiten befassen, müssen sich die Marken über die grundlegende Prämisse im Klaren sein: Die FDA-Anforderungen für Aufhellungsseren beruhen auf dem Prinzip “Sicherheit zuerst”. Derzeit, kein rezeptfreies Aufhellungsserum ist von der FDA zugelassen.
1.Kernverbot: Der illegale Status von Hydrochinon in OTC-Produkten
Dies ist der kritischste Aspekt der FDA-Anforderungen für Aufhellungsseren. Unter der CARES-Gesetz Ab 2020 werden alle rezeptfreien Hautaufhellungsprodukte, die Hydrochinon enthalten, als “neue Arzneimittel” eingestuft. Das bedeutet, dass die Vermarktung solcher Produkte illegal ist, es sei denn, ein Hersteller schließt das langwierige und kostspielige NDA-Verfahren (New Drug Application) ab und erhält die Zulassung. Die FDA hat an mehrere Unternehmen, die die Vorschriften nicht einhalten, Warnschreiben verschickt.
2.Absolute rote Linie: Striktes Verbot von Quecksilber und anderen Schwermetallen
Die FDA-Vorschriften für Bleichseren verbieten ausdrücklich die Zugabe von Quecksilber (z. B. Quecksilberchlorid, Kalomel) in jeglicher Form. Quecksilber ist hochgiftig für das menschliche Nervensystem, die Nieren und vieles mehr. Die Verbraucher sollten auf der Liste der Inhaltsstoffe auf Aliasnamen wie “Quecksilberchlorid” oder “Kalomel” achten.
3. die einzige Ausnahme: Der Weg zu verschreibungspflichtigen Medikamenten
Derzeit ist das einzige von der FDA zugelassene Produkt mit Hydrochinon in den USA das verschreibungspflichtige Medikament Tri-Luma, Das Präparat ist nur für die kurzfristige Behandlung von mittelschweren bis schweren dunklen Flecken im Zusammenhang mit Melasma zugelassen.
II. Eingehende Analyse: Die Sicherheitslogik hinter den strengen FDA-Anforderungen
Die strengen Anforderungen der FDA an Bleichseren ergeben sich aus der Bewertung der nachgewiesenen Risiken und dem Auftrag, die Gesundheit der Verbraucher zu schützen.
1. bestätigte Gesundheitsgefahren durch nicht-konforme Produkte
Die von der FDA gesammelten Berichte über unerwünschte Ereignisse weisen darauf hin, dass die Verwendung von OTC-Produkten, die Hydrochinon enthalten, zu Problemen führen kann:
- Exogene Ochronose: Eine potenziell dauerhafte blauschwarze Hautpigmentierung.
- Schwere Hautreizungen, Hautausschläge und Kontaktdermatitis.
- Ungewöhnlich erhöhte Hautempfindlichkeit.
2. seit langem bestehende Bedenken hinsichtlich der Karzinogenität
Bereits 2006 äußerte die FDA auf der Grundlage von Tierversuchsdaten Bedenken hinsichtlich des potenziell karzinogenen Risikos von Hydrochinon. Obwohl die Beweise für den Menschen nach wie vor nicht schlüssig sind, bilden diese Bedenken den historischen Kontext für die vorsichtige Regulierung des Stoffes.
3. die Kontrolle über unkontrollierten Missbrauch
Verbraucher, die keine fachliche Anleitung erhalten, können Produkte über einen längeren Zeitraum hinweg übermäßig verwenden, was die Risiken noch erhöht. Die FDA-Vorschriften für Bleichseren zielen darauf ab, die Verwendung solch potenter Inhaltsstoffe streng auf medizinisch überwachte Bereiche zu beschränken.
III. Marken-Aktionsleitfaden: Entwicklung konformer Whitening-Seren im Rahmen der FDA
Angesichts der klaren FDA-Anforderungen für Whitening-Seren müssen die Marken ihre F&E, ihre Behauptungen und ihre Markteintrittsstrategien anpassen.
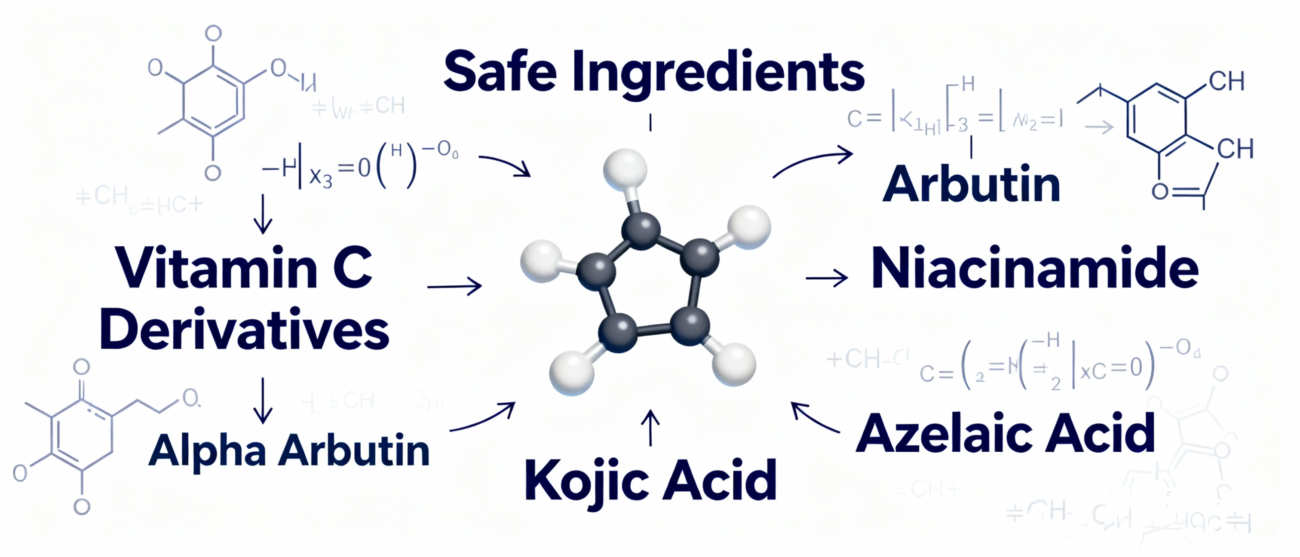
1. die Formulierungsstrategie: Umstellung auf sichere und wirksame alternative Inhaltsstoffsysteme
Völliger Verzicht auf Hydrochinon in rezeptfreien Produkten. Der Schwerpunkt sollte auf Inhaltsstoffe mit bewährter Sicherheitsbilanz und klaren Wirkmechanismen gelegt werden:
- Antioxidation & Hemmung der Melaninproduktion: Verwenden Sie stabile Vitamin-C-Derivate, Kojisäure, Arbutin, usw.
- Blockierung der Melaninübertragung: Niacinamid ist eine zentrale, durch Forschung bestätigte sichere Wahl.
- Beschleunigung der Keratinozyten-Erneuerung: Verwenden Sie Alpha-Hydroxysäuren oder Salicylsäure (Konzentrationsgrenzen beachten), um das Verblassen von Oberflächenpigmenten zu unterstützen.
2.Claim-Strategie: Präzise Formulierung unter strikter Einhaltung der “kosmetischen” Grenzen
Produktangaben müssen sich streng an die Definition von Kosmetika halten. Jede Aussage, die impliziert, dass das Produkt eine Hautkrankheit “behandeln” oder “heilen” kann, führt dazu, dass es als Arzneimittel eingestuft wird.
- Beispiele für konforme Ansprüche: “Hilft, den Hautton aufzuhellen”, “verbessert das Erscheinungsbild von Mattigkeit”, “hilft, das Erscheinungsbild von sonnenbedingten dunklen Flecken zu reduzieren”.”
- Zu vermeidende Hochrisikofälle: “Behandelt Melasma”, “entfernt Sommersprossen”, “blockiert Melanome”, “bietet klinisch wirksame Aufhellungseffekte”.”
3.Compliance Pathway Options: Die zwei einzigen Wege
Gemäß den FDA-Anforderungen für Aufhellungsseren stehen den Marken nur zwei Wege offen:
- Der Mainstream-Pfad: Entwicklung konformer OTC-Kosmetika
- Der Nischenweg: Eine neue Medikamentenanwendung anstreben
IV. Marktanpassung und Verbraucherkommunikation: Compliance als Vertrauensgut
Im neuen regulatorischen Umfeld sollten führende Marken proaktiv die FDA-Anforderungen für Whitening-Seren als Markenverantwortung verinnerlichen.
1. proaktive Bildung zum Aufbau eines transparenten Images
Erklären Sie den Verbrauchern, warum sicherere Alternativen gewählt werden, klären Sie sie über die Risiken von Hydrochinon und Quecksilber auf und machen Sie aus der Einhaltung der Vorschriften einen Ruf für Professionalität und Verantwortung.
2. die Verbraucher bei der Identifizierung von nicht konformen Produkten zu unterstützen
Helfen Sie den Verbrauchern, ein Unterscheidungsvermögen zu entwickeln, damit sie bei Produkten mit unvollständiger Kennzeichnung, übermäßig aggressiven Behauptungen oder aus unbekannten Quellen vorsichtig sind.
3. sich für eine gesunde Hautpflegephilosophie einzusetzen
Verlagerung des Marktschwerpunkts von der reinen “Hautaufhellung” auf “Gleichmäßigkeit des Hauttons, Hautgesundheit und allgemeine Ausstrahlung” im Einklang mit dem Auftrag der FDA zum Schutz der öffentlichen Gesundheit.
V. FAQ: Vertiefung des Verständnisses der FDA-Anforderungen
Gibt es derzeit von der FDA zugelassene rezeptfreie Aufhellungsseren?
Nein, derzeit gibt es keine. Die FDA-Anforderungen für Aufhellungsseren besagen eindeutig, dass alle Produkte, die als rezeptfreie Aufhellungsseren mit Hydrochinon vermarktet werden, illegal verkauft werden.
Entspricht ein Bleichserum, das frei von Hydrochinon und Quecksilber ist, den Anforderungen der FDA?
Die Vermeidung dieser beiden verbotenen Inhaltsstoffe ist die Grundlage für die Einhaltung der Vorschriften, aber sie ist nicht alles. Marken müssen auch sicherstellen, dass alle Inhaltsstoffe in den angegebenen Konzentrationen sicher sind und dass alle Angaben streng innerhalb der Kosmetikkategorie liegen.
Wie sollte eine Marke reagieren, wenn sie ein FDA-Warnschreiben zu einem Aufhellungsprodukt erhält?
In der Regel verlangt die FDA von einem Unternehmen, dass es innerhalb von 15 Arbeitstagen mit einem Plan für die sofortige Einstellung des Verkaufs, die Entfernung vom Markt und Korrekturmaßnahmen reagiert.
Wie könnten sich die FDA-Anforderungen für Aufhellungsseren in Zukunft entwickeln?
Es wird erwartet, dass die FDA weiterhin verstärkt gegen illegale OTC-Produkte vorgehen wird, insbesondere gegen solche, die online verkauft oder importiert werden, und dass sie höhere Anforderungen an die Sicherheit und die wissenschaftliche Absicherung stellen wird.
VI. Schlussfolgerung und Ausblick: Die Suche nach Innovationsmöglichkeiten im Rahmen der Compliance
Im Jahr 2026 wird die FDA-Anforderungen für Aufhellungsseren klare Grenzen für die Industrie zu ziehen: Sicherheit ist die absolute rote Linie, und die Einhaltung der Vorschriften ist der einzige Einstiegspunkt.
- Aufrechterhaltung der Compliance-Grundlage: Vollständiger Verzicht auf die Verwendung von Hydrochinon oder Quecksilber in rezeptfreien Produkten.
- Fokus auf wissenschaftliche Innovation: Verstärkte Investitionen in die Forschung zu sicheren Bleichmitteln, um die Wettbewerbsfähigkeit durch solide wissenschaftliche Erkenntnisse zu stärken.
- Ein Treuhandvermögen aufbauen: Transparenz, Verbraucheraufklärung und verantwortungsbewusste Behauptungen in den Mittelpunkt der Markenkommunikation stellen.
Künftig werden auf dem US-Markt diejenigen Whitening-Marken erfolgreich sein, die nicht nur die FDA-Anforderungen für Whitening-Seren verstehen, sondern sie auch als Eckpfeiler nutzen, um im Rahmen von Sicherheit, Wissenschaft und Integrität einen echten Mehrwert zu schaffen.
Wenn Sie auf der Suche nach einem zuverlässigen OEM-Hersteller für Hautpflegeprodukte sind, der Ihre Produktkonformität und Ihren Erfolg unterstützt, laden wir Sie ein Kontaktieren Sie uns.